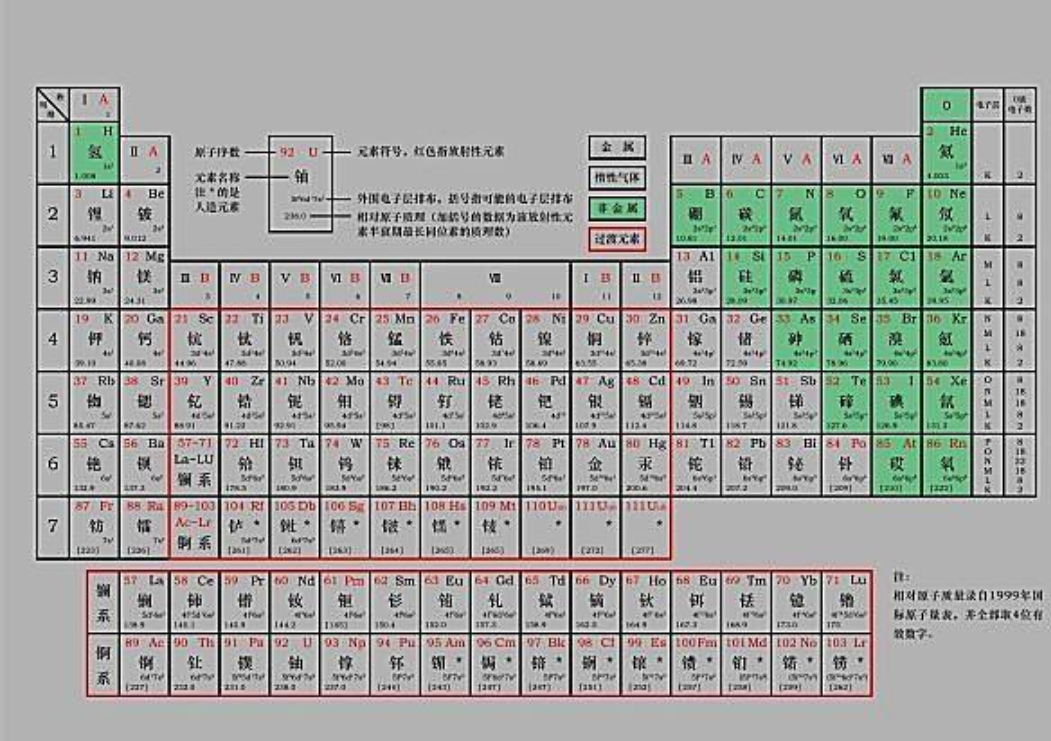
元素周期律总结
的有关信息介绍如下:
元素周期律总结为:
一、元素的金属性和非金属性的周期性变化:
电子层数相同,随着原子序数的递增,原子半径递减,核对核外电子的引力逐渐增强,失电子能力逐渐减弱,得电子能力逐渐增强,即元素的金属性逐渐减弱,非金属性逐渐增强。
二、微粒半径大小的比较规律:
1. 电子层数相同,核电荷数越大半径小。
2. 电子层数不同,电子层数越多半径越大
3. 核电荷数相同,化合价越高半径越小
4. 电子层结构相同,核电荷数大,则半径小
元素周期律总结得实验验证:
1、元素的金属性:指元素气态原子失去电子的能力。
a.金属单质跟水或酸反应置换出氢气的难易程度:越容易则金属性越强,反之,金属性越弱;
b.最高价氧化物对应水化物的碱性强弱:最高价氢氧化物的碱性越强,这种金属元素金属性越强,反之,金属性越弱;
2、元素的非金属性:指元素气态原子得到电子的能力。
a.非金属元素单质与氢气化合的难易程度及生成氢化物的稳定性强弱:如果元素的单质跟氢气化合生成气态氢化物容易且稳定,则证明这种元素的非金属性较强,反之,则非金属性较弱;
b.最高价氧化物对应水化物的酸性强弱:酸性越强则对应的元素的非金属性越强;
c.非金属单质间的置换反应