非金属性是什么呢?
的有关信息介绍如下:元素的非金属性是指元素的原子得电子拦行的能力。
根据周期表判断,在同一周期中,从左向右金属性逐渐减弱,非金属性逐渐增强;在同一主族中,从上向下,金属性逐渐增强,非金属性逐渐减弱。
它的最高价氧化物的水化物的酸性强弱。若该水化物的酸性越强,则元素的非金属性越强;反之,则越弱。如酸性HClO4 (最强酸)>H2SO4 (强酸)>H3PO4 (中强酸)>H4SiO4(弱酸),则非金属性Cl > S > P > Si。
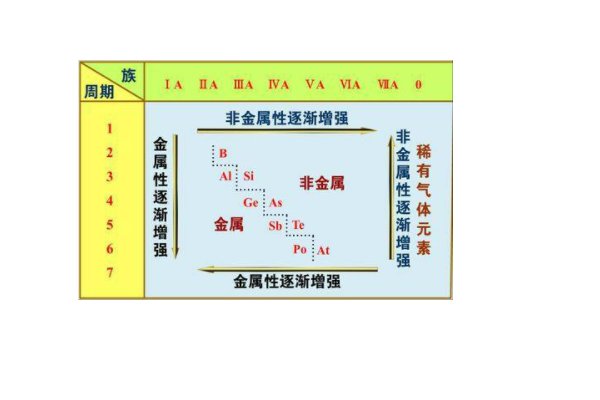
辨析金属性和非金属性
化学反应中金属元素的原子失去电子的能力。失电子能力越强的粒子所属的元素金属性就越强;反之越弱,而其非金属性就越强。
金属性常表示元素的原子失去电子的倾向;元素的非金属性是指元素的原子得电子的能力。由单质与水反应转换出氢的难易程度判断,单质与置换出氢越容易,元素的金属性越强。
由最高价氧化物的水化物,即氢氧化物的碱性强弱来判断。最高价氢氧化物碱性越强,元素的金属性越强由金属活动性顺序表进行判断。按金属活动性顺序,金属元素的金属性依次减弱。
由单质的还原仔厅性判断。或单质的还原性越强,则对应元素的金属性越强。由单质与化合物之间的置换反应判断。遵循强制弱的规律。由金属阳离子的念衡隐氧化性强弱判断。一般情况下,金属阳离子的氧化。



